يُعد الأرغون هو الغاز الخامل الأكثر شيوعًا في صناديق القفازات وخطوط شلينك للتجارب شديدة الحساسية. في حين أن النيتروجين بديل أقل تكلفة وأكثر شيوعًا، يُفضل الأرغون بشكل صارم عندما يكون هناك أي خطر لتفاعل الغاز "الخامل" مع المواد التجريبية، وهو ما يمكن أن يحدث مع معادن معينة أو في درجات حرارة عالية.
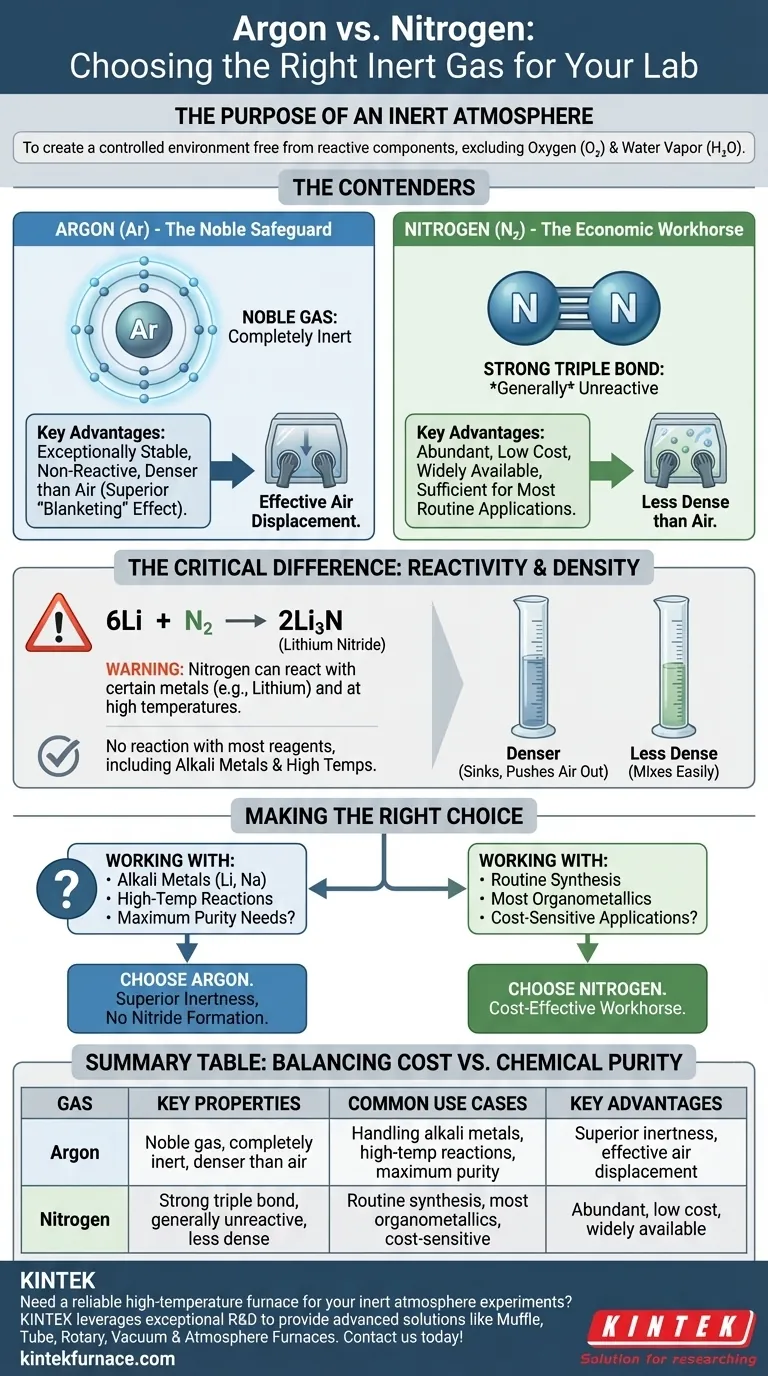
يعد الاختيار بين الأرغون والنيتروجين قرارًا حاسمًا في الكيمياء الحساسة للهواء، حيث يوازن بين التكلفة والنقاء الكيميائي. بينما يعد النيتروجين عنصر عمل فعال من حيث التكلفة، يوفر الأرغون مستوى فائقًا من الخمول، ويعمل كضمان أساسي للتجارب عالية التفاعل أو التي تتم في درجات حرارة عالية.

الغرض من الجو الخامل
الوظيفة الأساسية لصندوق القفازات أو خط شلينك هي إنشاء بيئة خاضعة للرقابة وخالية من المكونات الجوية التفاعلية. المتهمون الرئيسيون الذين تحاول استبعادهم هم الأكسجين (O₂) وبخار الماء (H₂O)، اللذان يمكن أن يسببا تحلل الكواشف والمحفزات الحساسة بسهولة.
يُستخدم غاز خامل، مثل الأرغون أو النيتروجين، لإزاحة الهواء والحفاظ على ضغط إيجابي، مما يمنع أي تسرب للغلاف الجوي إلى النظام.
مقارنة المتنافسين: الأرغون مقابل النيتروجين
على الرغم من استخدام كليهما لإنشاء جو خامل، فإن خصائصهما الكيميائية والفيزيائية تحدد متى يكون أحدهما خيارًا أفضل من الآخر.
النيتروجين: عنصر العمل الاقتصادي
يشكل النيتروجين (N₂) حوالي 78% من الهواء الذي نتنفسه، وبالتالي فهو وفير وغير مكلف.
تتميز جزيئات N₂ برابطة ثلاثية قوية جدًا بين ذرتي النيتروجين. تتطلب هذه الرابطة كمية كبيرة من الطاقة لكسرها، ولهذا السبب يعتبر النيتروجين بشكل عام غير تفاعلي ومناسب لمجموعة واسعة من التطبيقات الكيميائية.
الأرغون: الحماية النبيلة
الأرغون (Ar) هو غاز نبيل. هذا يعني أن ذراته تحتوي على غلاف إلكتروني خارجي ممتلئ بالكامل، مما يجعله مستقرًا للغاية وغير تفاعلي.
في ظل جميع الظروف المعملية تقريبًا، لن يشكل الأرغون روابط كيميائية أو يتفاعل مع الكواشف الخاصة بك. هذا الخمول الكيميائي الأساسي هو أعظم قوته.
الفرق الحاسم: التفاعلية
مصطلح "خامل" نسبي. في حين أن النيتروجين غير تفاعلي في الغالب، إلا أنه ليس خاملًا تمامًا.
في ظل ظروف محددة، يمكن للنيتروجين أن يتفاعل مع بعض المعادن لتكوين نتْريدات معدنية. المثال الأكثر شيوعًا في الكيمياء التركيبية ينطوي على فلز الليثيوم، الذي يتفاعل بسهولة مع غاز N₂ حتى في درجة حرارة الغرفة لتكوين نيتريد الليثيوم (Li₃N).
6Li + N₂ → 2Li₃N
يمكن أن يؤدي هذا التفاعل الجانبي غير المرغوب فيه إلى استهلاك الكاشف الخاص بك وإدخال الشوائب. يمكن أن تحدث تفاعلات مماثلة مع الفلزات القلوية الأخرى، أو الفلزات القلوية الترابية، أو أثناء التفاعلات التي تتم في درجات حرارة عالية. الأرغون، كونه غازًا نبيلًا، لا يمتلك هذا العيب.
اعتبار عملي: كثافة الغاز
الفرق المادي الرئيسي هو الكثافة. الأرغون أكثر كثافة بحوالي 40٪ من الهواء، بينما النيتروجين أقل كثافة بقليل من الهواء.
هذا يعني أن الأرغون أكثر فعالية في إزاحة الهواء من الوعاء، لأنه "يغرق" ويدفع الهواء الأخف إلى الأعلى والخارج. هذا التأثير "الغطائي" يجعله متفوقًا لتطهير الأواني الزجاجية على خط شلينك والحفاظ على جو مستقر داخل صندوق القفازات، لأنه يستقر في الأسفل بدلاً من الاختلاط بسهولة.
فهم المفاضلات
يتطلب اختيار الغاز المناسب الموازنة بين السلامة المطلقة والقيود العملية.
التكلفة: الدافع الأساسي
الميزة الأهم للنيتروجين هي تكلفته المنخفضة. الأرغون أغلى بكثير من النيتروجين.
بالنسبة للمختبرات التي تشغل العديد من صناديق القفازات أو تجري تخليقًا على نطاق واسع، يمكن أن يكون فرق التكلفة هذا عاملاً مهمًا. لهذا السبب، غالبًا ما يكون النيتروجين هو الخيار الافتراضي لأي عمل لا يكون فيه تفاعله المحتمل مصدر قلق.
النقاء والإمداد
كلا الغازين متاحان تجاريًا بدرجات نقاء عالية جدًا (على سبيل المثال، 99.999٪). يكمن الاختلاف الرئيسي غالبًا في طريقة الإمداد.
قد يكون لدى مستخدمي النيتروجين على نطاق واسع مولدات في الموقع أو خزانات نتروجين سائل كبيرة توفر إمدادًا مستمرًا للغاز من التبخر، مما يقلل من تكلفته التشغيلية. يتم دائمًا تزويد الأرغون في أسطوانات غاز عالية الضغط، والتي تتطلب استبدالًا منتظمًا.
اتخاذ القرار الصحيح لتجربتك
يجب أن يعتمد قرارك على الكيمياء المحددة التي تقوم بها.
- إذا كان تركيزك الأساسي هو التخليق الروتيني أو التنقية أو التعامل مع معظم المركبات العضوية المعدنية: استخدم النيتروجين. إنه خامل بما فيه الكفاية لمعظم التطبيقات ويوفر توفيرًا كبيرًا في التكاليف.
- إذا كان تركيزك الأساسي هو العمل مع الليثيوم أو الفلزات القلوية الأخرى، أو إجراء تفاعلات درجات الحرارة العالية: استخدم الأرغون. خموله الفائق غير قابل للتفاوض ويحمي تجربتك من تكوين نتْريدات معدنية غير مرغوب فيها.
- إذا كان تركيزك الأساسي هو تحقيق أقصى قدر من اليقين وإزالة جميع المتغيرات: استخدم الأرغون. التكلفة الأعلى هي ثمن زهيد للتأمين على أن غازك الخامل خامل حقًا.
في نهاية المطاف، فهم التفاعلية الدقيقة للنيتروجين هو ما يفصل الممارسة الروتينية عن التصميم التجريبي الدقيق والمتعمد.
جدول ملخص:
| الغاز | الخصائص الرئيسية | حالات الاستخدام الشائعة | المزايا الرئيسية |
|---|---|---|---|
| الأرغون | غاز نبيل، خامل تمامًا، أكثر كثافة من الهواء | التعامل مع الفلزات القلوية، التفاعلات عالية الحرارة، متطلبات النقاء القصوى | خمول فائق، إزاحة فعالة للهواء، لا يتكون منه نتْريدات |
| النيتروجين | رابطة ثلاثية قوية، غير تفاعلي بشكل عام، أقل كثافة من الهواء | التخليق الروتيني، معظم المركبات العضوية المعدنية، التطبيقات الحساسة للتكلفة | متوفر بكثرة، تكلفة منخفضة، متاح على نطاق واسع |
هل تحتاج إلى فرن موثوق لدرجات الحرارة العالية لتجاربك في الجو الخامل؟ تستفيد KINTEK من البحث والتطوير الاستثنائي والتصنيع الداخلي لتوفير حلول متقدمة مثل أفران الحجرة، الأنبوبية، الدوارة، التفريغ والجو الخامل، وأنظمة CVD/PECVD. بفضل إمكانيات التخصيص العميق القوية، فإننا نلبي بدقة متطلباتك التجريبية الفريدة. اتصل بنا اليوم لتعزيز كفاءة وأمان مختبرك!
دليل مرئي
المنتجات ذات الصلة
- 1200 ℃ فرن نيتروجين خامل خامل متحكم به في الغلاف الجوي
- فرن فرن الغلاف الجوي المتحكم فيه بالحزام الشبكي فرن الغلاف الجوي النيتروجيني الخامل
- فرن نيتروجين خامل خامل متحكم به 1700 ℃ فرن نيتروجين خامل متحكم به
- 1400 ℃ فرن نيتروجين خامل خامل متحكم به في الغلاف الجوي
- فرن الغلاف الجوي الهيدروجيني الخامل المتحكم به بالنيتروجين الخامل
يسأل الناس أيضًا
- ما هو استخدام النيتروجين في الفرن؟ منع الأكسدة والتحكم في جودة المعالجة الحرارية
- كيف تمنع البيئة الخاملة الأكسدة؟ حماية المواد من أضرار الأكسجين
- ما هي فوائد المعالجة الحرارية في جو خامل؟ منع الأكسدة والحفاظ على سلامة المادة
- كيف تعمل معالجة الحرارة في جو خامل؟ منع الأكسدة للحصول على جودة مواد فائقة
- ما هي الفوائد البيئية لاستخدام الغازات الخاملة في الأفران؟ تقليل النفايات والانبعاثات لعملية أكثر اخضرارًا



















